
Pin-point塩基編集プラットフォームによる機能ゲノミクススクリーニング
Pin-pointプラットフォームによる塩基編集は、標的配列に対して精密かつ制御された変化をもたらし、オンターゲットおよびオフターゲットのDNA損傷の可能性を低減し、感受性の高い細胞種においても細胞の健全性を維持します。
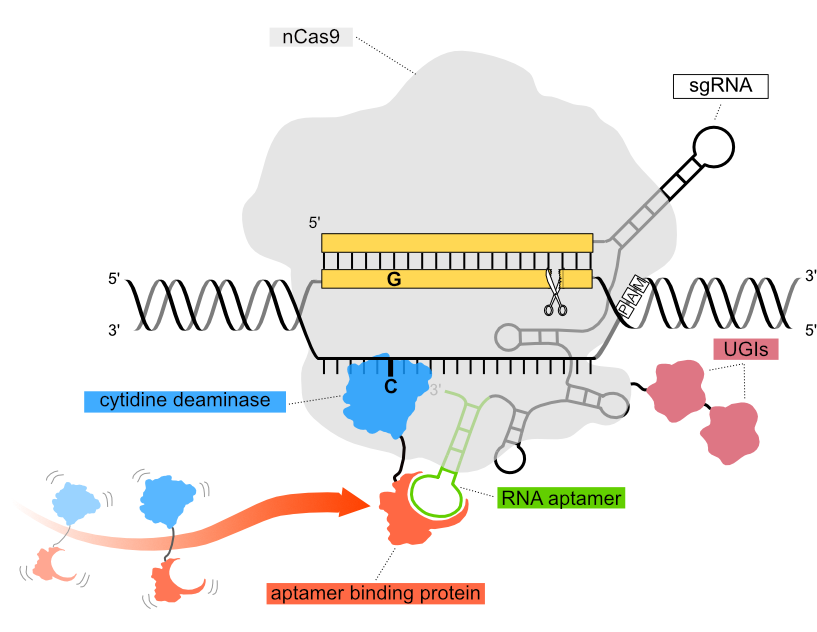
当社の機能ゲノミクススクリーニングで使用されているPin-point塩基編集プラットフォーム構成では、ニカーゼCas9(nCas9)コンポーネントが、スキャフォールド領域にアプタマーをコードする単一ガイドRNA(sgRNA)を介してDNA標的配列にリクルートされます。アプタマーは、アプタマー結合タンパク質を介してDNA修飾デアミナーゼをDNA標的配列にリクルートします。このシステムの3つの独立したコンポーネントは、編集要件に応じて構成可能であり、mRNAとして、またはウイルスベクターにパッケージ化して細胞に導入することができます。
目的の遺伝子内のPAMでアクセス可能なすべてのシトシンを修飾することで、遺伝型と表現型の関係を比類なき精度で理解
当社の機能ゲノミクススクリーニングサービスの一環として、Pin-pointプラットフォームを用いたタイル型塩基編集スクリーニングにおいて、お客様と連携することが可能です。これらのタイル型塩基編集スクリーニングでは、DNA配列内のアクセス可能なすべてのシトシンを精密なC>T変異として置換して解析することができます。この情報は、治療用途に最適なガイドRNAの選定、構造と機能の解析における重要なアミノ酸の同定、創薬候補スクリーニングにおけるリガンド結合関係の検証や標的の同定などに活用できます。
FGSとPin-point塩基編集を組み合わせることで、以下が可能になります:
- スプライス部位を標的とし、早期終止コドンを導入することで、CRISPRkoおよびCRISPRiスクリーニングを再現
- 他の手法では明らかにできない可能性のあるミスセンス変異の導入による新規ヒットの同定
- 単一のスクリーニング内で機能喪失変異や機能増強変異を含めることで、薬剤感受性・耐性やタンパク質機能の作用機序を解明
- 異なるデアミナーゼの活用による編集ウィンドウの最大化と、より広範な遺伝配列の評価
- ヒットリストの作成や原因となり得る変異の同定に向けて、当社のデータ解析を活用
- 薬剤と遺伝子の相互作用を探索し、感受性・耐性を明らかにするとともに、独自の機能的タンパク質ドメインを解明
当社のサービスチームは、CRISPRベースのプール化スクリーニングに関する幅広い専門知識を有しており、Pin-point塩基編集プラットフォームの開発にも直接関与しているため、他にはない支援体制を提供できます。
プール化タイル型塩基編集スクリーニングはどのように機能するか?
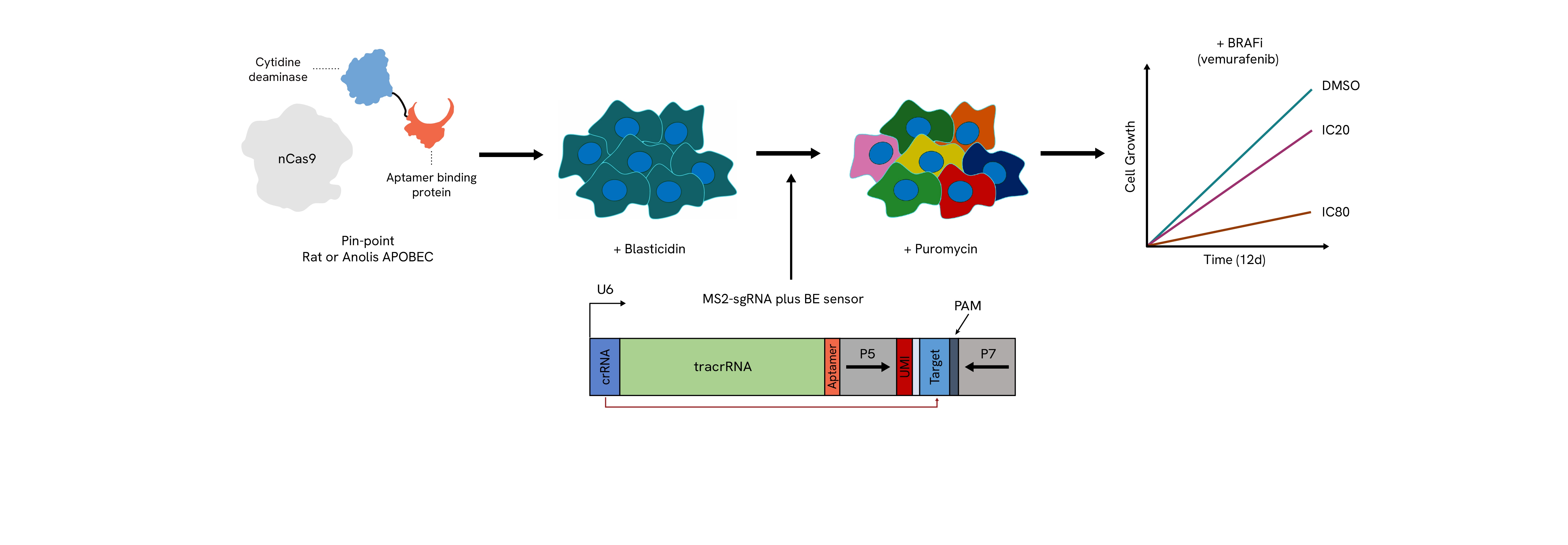
Pin-pointプラットフォームの構成要素は、ラットまたはアノリス由来のAPOBECデアミナーゼを発現する細胞に安定的に導入されます。対応する標的配列を含むセンサー要素を組み込んだsgRNAライブラリーは、高いカバレッジでレンチウイルスを用いて細胞に導入されます。センサーの存在により、プール化スクリーニング形式でNGSを用いて内因性遺伝子座で達成可能な編集の測定が可能になります。sgRNAを選択した後、細胞はIC20またはIC80濃度の化合物(例:ベムラフェニブ)で処理され、薬剤に対する感受性または耐性を示す変化が明らかにされます。スクリーニング期間中はサンプルが採取され、NGS解析により編集達成度およびガイド配列の減少または濃縮が評価されます。
スクリーニングデータ例
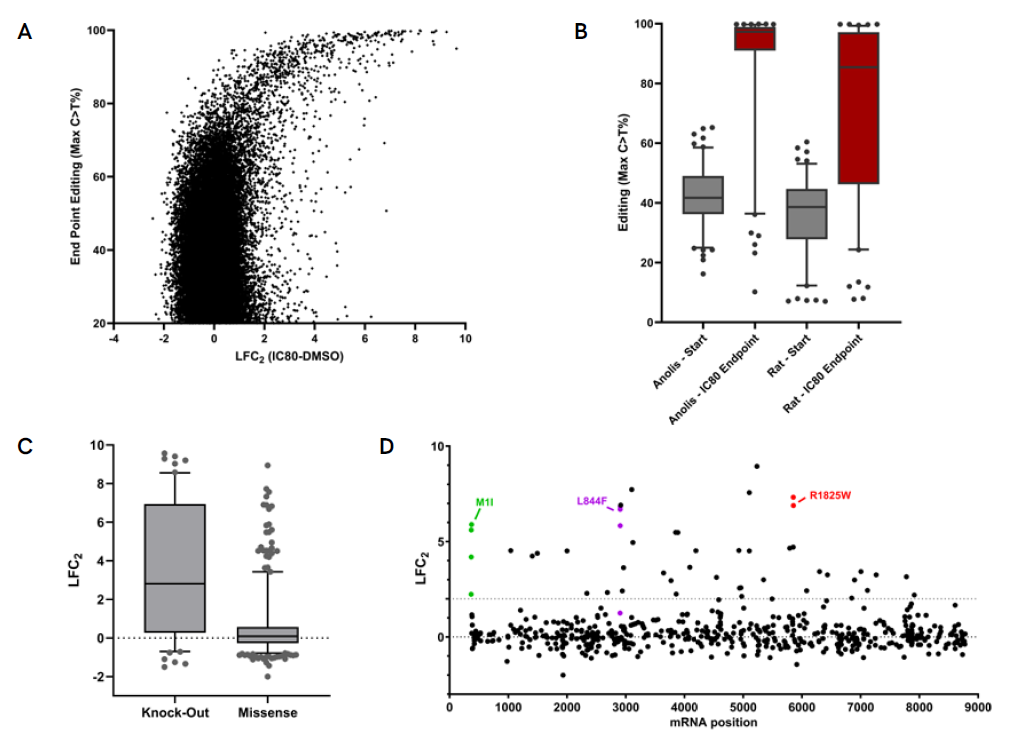
A. IC80スクリーニングのエンドポイントデータでは、薬剤耐性を付与するガイドの濃縮が編集レベルの上昇と相関していることが示されています。B. 耐性を付与することが示されたガイドの編集レベルをスクリーニングの開始時と終了時で比較すると、編集されたゲノムの強い濃縮が確認されます。初期の編集レベルが高いアノリス由来APOBECを用いたPin-pointプラットフォーム構成では、濃縮がより顕著です。Neurofibromin 1(NF1)の発現喪失は、これまでにBRAFi耐性を付与することが報告されています。C. NF1のmRNAスプライス部位を標的とする、またはナンセンス変異を導入することでNF1ノックアウトを引き起こすガイドは、ミスセンス変異を導入するガイドと比較して薬剤耐性を付与する可能性が高いことが示されています。D. 耐性を付与するミスセンス変異はNF1遺伝子内にホットスポット領域を示さず、これは臨床的な観察結果と一致しています。同じ耐性変異を導入する複数のガイドは、類似したスクリーニング表現型を示すことが確認されています。
構成内容
- C>T塩基変化を全遺伝子、アンプリコン、またはご希望のカスタム標的領域全体にわたって導入するためのタイル型ガイドRNA
- Pin-point塩基編集プラットフォームの編集ウィンドウを狭域または広域に調整可能
- 塩基編集コンポーネントの安定発現または一過性発現
- 対象領域に合わせて当社の専門チームが設計するカスタムガイドRNAライブラリー
- 各カスタムプール化ライブラリーは、代表性、分布、粒子力価について品質確認を実施し、安定した結果を保証
- 各gRNAの編集結果は内部センサー配列を介して読み出し可能
- 次世代シーケンシングによるレポートとバイオインフォマティクス解析、ヒット候補の提示案
- 細胞健康性の向上:
- 二本鎖DNA切断を回避しながら変異を導入することで、特に感受性の高い細胞種において細胞毒性を低減
- 野生型CRISPR研究でDNA損傷に対して感受性を示す細胞への編集の実現






























